종목토론카테고리
게시판버튼
게시글 제목
허쥬마, 유럽에서 선보이기 위해 심사대에 올라게시글 내용
심사 과정에서 3파전 예상
충분한 임상 자료를 축적한 허쥬마
먼저 최근에 가장 핫 뉴스를 꼽으라면 램시마 임상 결과의 ECCO 발표입니다
외신에서 영어 스페인어 불어 독일어 중국어 등 주요 언어권에서 보도하고 있고
시차를 두고 국내 언론에서도 많이 보도하고 있습니다
그 진정한 의미는 이 게시판을 이용하시는 분들이 먼저 깊이 아실 것입니다
허쥬마에 관한 얘기를하려고 합니다
셀트리온이 낸 2월 20일 ECCO 발표에 관한 보도자료의 일부를 인용하여 봅니다
셀트리온 관계자는 “염증성 장질환 대상 임상은 램시마(미국판매명:인플렉트라)의 미국 유통을 담당하고 있는 화이자가 셀트리온과 공동으로 투자한 임상 연구 프로젝트로, 램시마의 미국 시장 마케팅에 활용할 처방 근거 확보 일환으로 진행됐다”며 “유럽은 물론 세계 최대의 바이오의약품 시장인 미국에서도 임상 자료를 바탕으로 빠른 시장 진입을 기대하고 있다“고 말했다. 이 관계자는 또 “트룩시마와 허쥬마 등 후발 바이오시밀러 역시 조기 시장진입을 위한 적응증별 임상을 계획하고 있다”고 덧붙였다
셀트리온은 의약시장에서 신뢰를 얻기 위해 자료를 중요시하는 회사입니다
가격으로만 경쟁하는 회사가 아니고 기존 글로벌 거대제약사의 아성에 침투하기 위하여 실력을 기르고 있다고 보면 됩니다
램시마에 관한 자료가 눈덩이처럼 나날이 불어만 가는데
허쥬마의 경우에도 평행하게 진행되는 상황을 관찰하게 될 것 같습니다
현재까지 유럽 EMA에 판매승인 신청서를 접수시킨 허셉틴 바이오시밀러는 세 종류입니다
Mylan/Bicon 연합, MSD / Samsung 연합, 그리고 셀트리온이
한달반 차이로 출발하였으나 최종 심사는 누가 먼저 받을지 예측하기 어렵습니다
심사과정에 장시간의 질문과 답변 기간이 포함되기 때문에 제출 자료의 내용과 대응에 따라 전체 심사기간이 달라질 수 있습니다
최종 심사일에 “highly similar”로 승인을 추천받느냐 아니면 신청철회 권고를 받느냐 하는 갈림길에 서야 하는 것은 다른 문제입니다
승인받는 것과 상품화하여 잘 팔리는 것은 정말로 또 다른 문제입니다
이미 램시마와 다른 후보의 격차를 이미 목격하고 있지 않습니까
램시마는 수많은 자료를 확보하고 있는 약품입니다
ECCO 행사장에 차려진 부스 위에 붙어있는 배너가 웅변하고 있습니다
“스위칭 임상 연구”, “8000건 실제 치료 자료“, 및 ”10만 환자 처방“ 등
http://www.celltrion.com/pr/reportDetail.do?seq=367
후발 바이오시밀러들이 따라 오기 힘든 장애물들이 계속 나오고 있습니다
허셉틴 바이오시밀러 얘기로 돌아가 볼까요
아시겠지만 대조약 허셉틴의 승인받은 적응증은 HER2-양성 조기 유방암, 전이성 유방암, 전이성 위암 치료입니다
세 후보를 비교해보면 임상 자료에서 차이가 많이 납니다
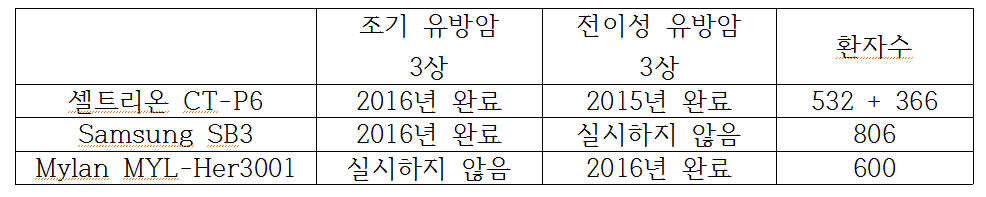
셀트리온 CT-P6는 전이성 유방암에 대해 2013년과 2015년에 3상을 끝냈습니다
이후 바로 EMA에 약품판매 승인을 신청한게 아니라 조기 유방암에 대한 3상을 실시하여 2016년에 마무리합니다 참여 환자수는 각각 366명과 532명
자료를 충분히 확보할 시간을 보내느라 후발 바이오시밀러 후보와 거의 비슷한 시기에 허가신청서를 냈던 것입니다
MSD/Samsung SB3 후보는 조기 유방암과 국소적으로 진전된 유방암에 대하여 3상을 하였죠 전이성에 대한 자료를 찾을 수 없습니다
인도 Bicon과 스위스 Mylan의 MYL-1401O (MYL-Her3001) 후보는 조기 유방암에 대한 임상 실적이 없이 전이성 유방암만 3상을 마친 것 같습니다
심사에서 적응증 외삽을 어느 정도 인정해주면 차이가 나지 않을 것입니다 만에 하나 그런다해도 확보한 임상 자료에서 차이는 엄청난 것입니다
셀트리온과의 차이를 만회하려면 많은 시간과 개발비용이 더 필요할 것입니다
진정한 선두 주자(first mover)는 누가될 것인지 곧 자명해질 것입니다
유럽 다음에는 미국 FDA에서 심사받을텐데 어느 회사가 마음이 더 편할런지 금방 알 수 있습니다
시험 과정에 들어가면 응시자는 누구나 장담할 수 없습니다 차분하게 결과가 나올 때까지 지켜보는 길밖에 없습니다
3상 |
3상 |
CT-P6 |
2016년 완료 |
2015년 완료 |
532 + 366 |
Samsung SB3 |
2016년 완료 |
806 |
|||
Mylan MYL-Her3001 |
2016년 완료 |
600 |
▲ 위 이미지를 클릭하시면 원본 이미지를 보실 수 있습니다.
위표에서 허쥬마의 전이성 3상 완료시기는 기록상 2015년을 반영한 것이지만 실제로는 2013년에 끝냈을 것입니다 (끝)
게시글 찬성/반대
- 151추천
- 1반대
운영배심원의견
운영배심원의견이란
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.







댓글목록