종목토론카테고리
게시판버튼
게시글 제목
간암서 '리보세라닙+PD-1항체' 美3상 승인게시글 내용
한국에서 최초로 글로벌제약 1호 신약 "리보세라닙" '19년 하반기 미FDA에 신약등록
진양곤회장의 비젼제시 PPT ☜클릭
에이치엘비는 자회사 LSK Biopharma(LSKB)와 항서제약(Jiangsu Hengrui)이 미국 식품의약국(FDA)으로부터 진행성 간세포암 환자를 대상으로 하는 임상3상을 승인받았다고 9일 밝혔다. 항서제약은 리보세라닙의 중국 판권을 보유하고 있다.
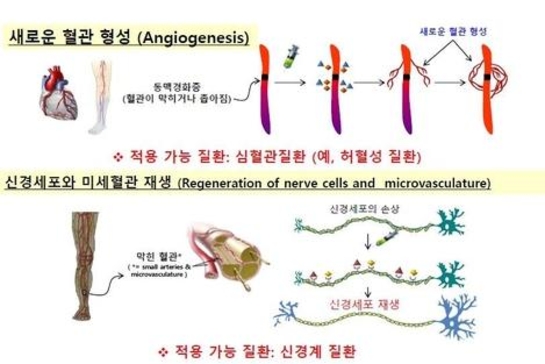
두 회사는 미국 중국 등 사이트에서 임상개발을 진행하며, 진행성 간세포암(Advanced HCC) 1차 치료제를 목표로 혈관내피세포 성장인자 수용체-2(VEGFR-2) 저해제인 '리보세라닙'과 인간화 PD-1 항체인 '캄렐리주맙(Camrelizumab, SHR-1210)'을 병용투여해 약물 효능 및 안전성을 평가할 계획이다. 대조 약물로 진행성 간세포암 1차 약제로 사용되고 있는 넥사바와 비교하게 된다. 리보세라닙은 암조직에 산소·영양분을 공급하는 신생혈관생성을 억제하면서 동시에 비정상적인 종양혈관 및 면역억제 환경을 정상화시키는 메커니즘으로 작동해, PD-1 항체와 시너지 효과를 발휘할 것으로 기대한다.
항서제약은 클래식 호지킨림프종(classic Hodgkin Lymphoma, cHL) 환자를 대상으로 캄렐리주맙의 중국 내 시판허가 신청서(NDA)를 제출한 상태며, 항서제약은 위암 치료제로 아파티닙을 판매하고 있다.
김성철 LSKB 대표는 “항서제약과의 글로벌 공동 개발을 통해 리보세라닙과 캄렐리주맙 병용 요법이 향후 더 많은 진행성 간세포암 환자들에게 희망을 줄 수 있기를 바란다”고 발혔다. Piaoyang Sung 항서제약 회장은 “이번 임상시험의 승인은 회사의 사명을 위한 하나의 이정표로, LSKB와의 협력을 통해 진행성 간세포암 환자에게 공동으로 도움을 줄 수 있기를 기대한다”고 전했다.
항서제약은 현재 중국에서 진행성 간세포암을 대상으로 리보세라닙과 캄렐리주맙의 병용투여에 따른 효능을 확인하기 위한 오픈라벨 다기관 임상2상(NCT03463876)을 진행하고 있으며, 올해 환자모집이 완료될 것으로 기대한다.
항서제약은 지난해 미국암학회(ASCO)에서 진행성 간세포암 중국인 환자 14명을 대상으로 두 약제를 병용투여한 결과 객관적반응률(ORR) 50.0%, 질병조절율(DCR) 85.7% 결과를 확인했다고 발표했다. 항서제약은 중국에서 비소세포폐암(NSCLC), 소세포폐암(SCLC), 위암(GC) 등 다양한 적응증을 대상으로 아파티닙과 PD-1 항체를 병용투여하는 임상을 진행하고 있다.
▲ 위 이미지를 클릭하시면 원본 이미지를 보실 수 있습니다.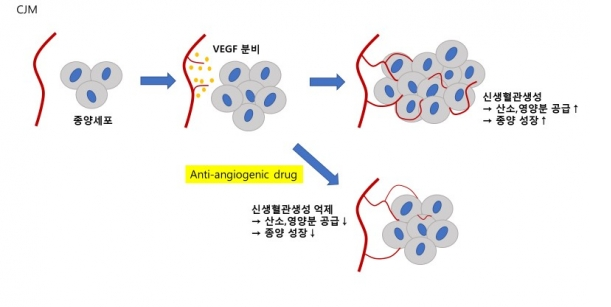
▲ 위 이미지를 클릭하시면 원본 이미지를 보실 수 있습니다.
▲ 위 이미지를 클릭하시면 원본 이미지를 보실 수 있습니다.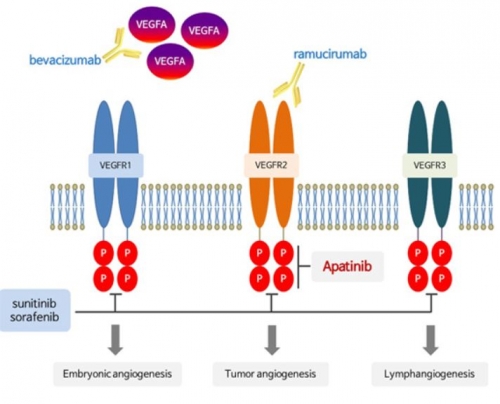
▲ 위 이미지를 클릭하시면 원본 이미지를 보실 수 있습니다.
게시글 찬성/반대
- 1추천
- 0반대
운영배심원의견
운영배심원의견이란
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.







댓글목록