종목토론카테고리
게시판버튼
게시글 제목
중국 의약품 개혁개방 가속화, 규제 모델은 한국형?게시글 내용
중국 의약품 규제당국이 임상과 허가 분야에서 개혁개방을 가속화 하고 있다. 마치 한국을 따라가는 듯한 모습이다. 국내 제약 RA전문가에게 중국의 의약품 신속허가를 위한 정책 변화는 주시할 만한 사항이다.
8일 국내 제약업계에 따르면 최근 식품의약품안전처 안전평가원과 중국 국가약품감독관리국(NMPA)은 최신 규제 정보를 공유하기 위한 회의를 개최했다.
이 자리에서 NMPA는 자국의 최신 규제 정보를 알렸는데 임상시험승인 제도와 우선 심사 제도, 품목허가 신청 가능 범위를 확대한다는 내용이 나왔다.
우선 NMPA는 임상시험 승인 문턱을 낮췄다. 국내 제약사가 중국 내 임상시험을 신청 이후 NMPA가 60일 이내 반대하지 않으면 암묵적인 동의로 간주하고 임상을 진행할 수 있다.
특히, 우리가 앞섰지만 중국이 빠른 속도로 ?아오는 분야는 우선 심사 제도와 품목허가 관련해서다. 업계에 따르면 중국은 의약품 규제 분야의 개혁개방을 멈추지 않고 있다.
중국은 에이즈, 암, 알츠하이머 등 혁신의약품과 특수질병과 관련해 우선 심사 제도를 도입한다. 심사기간 단축을 위해서다.
이와 관련 작년 10월 NMPA는 "지난 10년 간 미국, EU 일본에 등록됐으나 자국에 등록되지 않은 의약품 중 희귀 질환 치료 의약품, 생명을 위협하는 질병을 치료·예방할 수단이 없는 의약품, 명백한 임상적 이점이 있는 의약품을 임상시급신약(우선심사제도)으로 지정했다"며 심사 속도를 높일 수 있는 특별경로를 마련했다고 밝혔다.
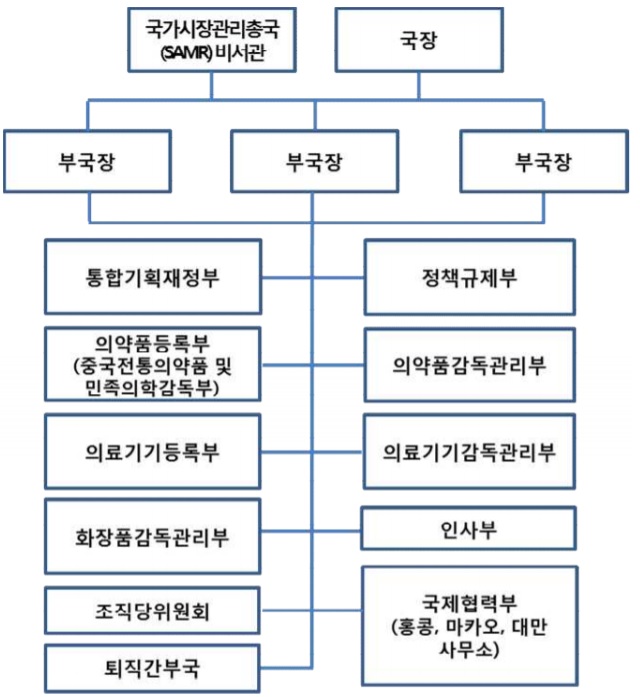
NMPA는 의약품평가센터(CDE)를 통해 우선 심사 제도 대상 품목을 40품목으로 정하고 차후 8품목을 추가하기로 했다. 아울러 기술적 심사 검토 기간도 희귀약은 3개월, 이 외 신약은 6개월 이내로 했다. 허가 여부도 CDE로부터 자료를 받은 뒤 10일(근무일 기준) 이내 결정한다는 방침을 세웠다.
국내 공동생동과 비슷한 제도도 NMPA는 확대한다. NMPA는 의약품 생산업체만 품목허가 신청토록 한 조건을 연구개발 기관과 연구자가 행하는 위탁제조 등으로 넓혔다. 이에 따라 직접 생산하지 않고도 위탁제조로만 품목허가를 받을 수 있다.
한편 중국은 신약을 확대하기 위한 정책을 규제 기관 개편과 인력 확대에도 많은 노력을 하고 있다. 그중 하나가 작년 9월 1일 중국식품의약품국(CFDA)을 NMPA로 개편한 것이다. NMPA는 중국국가시장관리총국(SAMR) 산하의 차관급 기관으로 의약품, 화장품, 의료기기 규제 정책 입안과 위해관리, 약사허가 등록까지 총괄하고 있다.
NMPA에 따르면 CDE 심사인력도 700명 이상으로 크게 늘었고 임상 심사 기간도 400일에서 120일로 단축했다.
게시글 찬성/반대
- 6추천
- 0반대
운영배심원의견
운영배심원의견이란
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.







댓글목록