종목토론카테고리
게시판버튼
게시글 제목
FDA 허가지원 확대...올해 고가항암제·희귀약 대거 출격게시글 내용
2020 글로벌 의약품시장 전망] ② 지난해 신약허가 54건...28조원 규모
60%가 의약품허가심사기간 단축...희귀의약품 허가 40%로 늘어
지난해 54개 신약이 미국식품의약품국(FDA) 허가관문을 넘었다. FDA가 신약개발 관련 지원정책을 적극 펼치면서 희귀의약품 허가 건수가 증가하고 있다는 분석이다. 신속심사 경로를 통해 예정보다 빨리 허가받는 사례도 늘었다.
FDA 허가 지원 확대는 의약품시장에 활력을 불어넣을 전망이다. 연매출 3조원 규모로 성장이 예상되는 ADC(항체약물복합체) 유방암 신약은 FDA 신속허가를 받고 시장 출사표를 던졌다. 그 밖에도 다양한 기전의 신약후보군들이 FDA 심사를 기다리고 있다.
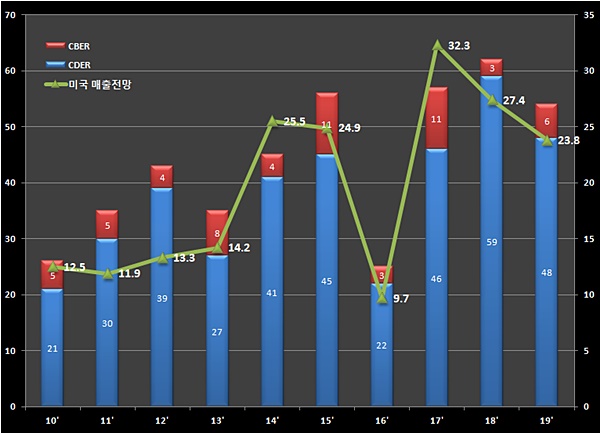
10일 FDA 최신 보고서에 따르면 지난해 FDA 신약 허가건수는 54건이다. 의약품평가연구센터(CDER)가 48건, 세포유전자치료제와 백신, 혈액제제 등의 허가를 주관하는 바이오의약품평가연구센터(CBER)가 6건의 신약을 승인했다.
FDA 허가 건수 기록을 세웠던 2018년(62건)보다는 줄었지만 최근 10년간 FDA 허가건수 평균치(43건)를 훌쩍 뛰어넘는 수치다. SK바이오팜이 지난 2011년 재즈파마슈티컬즈에 기술수출한 수면장애신약 '수노시(성분명 솔리암페톨)'와 뇌전증 치료제 '엑스코프리(성분명 세노바메이트)', 대웅제약이 개발한 보툴리눔독소제제 '주보(대웅제약 나보타의 미국상품명)' 등 국내 기술로 개발된 의약품 3건도 이름을 올렸다.
FDA가 획기적치료제 지정(BTD)과 우선심사, 가속허가 등 신약개발 관련 지원정책을 도입하면서 허가규제 완화기조를 나타낸 점이 의약품시장 활성과 접근성 증가에 긍정적인 영향을 끼쳤다는 분석이다.
FDA CDER 집계를 살펴보면 2010년까지 연평균 20건 정도로 부진하던 FDA 신약허가건수는 2011년 이후 2배 가량 증가했다. 2014년 41건, 2015년 45건, 2016년 22건, 2017년 46건 등의 추이를 나타내면서 평균 허가건수가 43건으로 올라섰다. 2018년에는 1996년 FDA 신약허가 53건을 깨고 신기록을 세운 바 있다.
글로벌 의약품 시장조사기관 이밸류에이트파마(EvaluatePharma)는 최신 보고서를 통해 지난해 FDA가 54개 신약에 허가를 내주면서 의약품시장 규모가 238억달러 증가할 것이란 전망을 내놨다.
FDA 허가현황에는 의약품시장 개발 트렌드도 반영된다. 지난해 CDER이 허가한 신약 명단을 살펴보면 희귀질환 치료제가 22건으로 44% 비중을 차지했다. 희귀질환 전문기업 버텍스파마슈티컬즈가 지난해 10월 허가받은 낭포성섬유증 치료신약 '트리카프타(Trikafta)'가 대표적이다. 버텍스는 F508del 유전자 변이를 한가지 이상 동반한 12세 이상 낭포성섬유증 환자 대상의 3상임상에서 폐기능개선 효과를 입증하면서 예정보다 5개월 빨리 FDA 허가를 받았다.
FDA 허가 지원 확대는 의약품시장에 활력을 불어넣을 전망이다. 연매출 3조원 규모로 성장이 예상되는 ADC(항체약물복합체) 유방암 신약은 FDA 신속허가를 받고 시장 출사표를 던졌다. 그 밖에도 다양한 기전의 신약후보군들이 FDA 심사를 기다리고 있다.

▲ 2010-2019년 FDA 신약허가건수와 5년 뒤 미국 예상매출액(단위: 건, 10억달러, 자료: 이밸류에이트파마·FDA, 데일리팜 재구성)
10일 FDA 최신 보고서에 따르면 지난해 FDA 신약 허가건수는 54건이다. 의약품평가연구센터(CDER)가 48건, 세포유전자치료제와 백신, 혈액제제 등의 허가를 주관하는 바이오의약품평가연구센터(CBER)가 6건의 신약을 승인했다.
FDA 허가 건수 기록을 세웠던 2018년(62건)보다는 줄었지만 최근 10년간 FDA 허가건수 평균치(43건)를 훌쩍 뛰어넘는 수치다. SK바이오팜이 지난 2011년 재즈파마슈티컬즈에 기술수출한 수면장애신약 '수노시(성분명 솔리암페톨)'와 뇌전증 치료제 '엑스코프리(성분명 세노바메이트)', 대웅제약이 개발한 보툴리눔독소제제 '주보(대웅제약 나보타의 미국상품명)' 등 국내 기술로 개발된 의약품 3건도 이름을 올렸다.
FDA가 획기적치료제 지정(BTD)과 우선심사, 가속허가 등 신약개발 관련 지원정책을 도입하면서 허가규제 완화기조를 나타낸 점이 의약품시장 활성과 접근성 증가에 긍정적인 영향을 끼쳤다는 분석이다.

▲ 국내 기술로 개발돼 미국에서 시판 중인 주보(왼쪽)와 수노시 제품사진
FDA CDER 집계를 살펴보면 2010년까지 연평균 20건 정도로 부진하던 FDA 신약허가건수는 2011년 이후 2배 가량 증가했다. 2014년 41건, 2015년 45건, 2016년 22건, 2017년 46건 등의 추이를 나타내면서 평균 허가건수가 43건으로 올라섰다. 2018년에는 1996년 FDA 신약허가 53건을 깨고 신기록을 세운 바 있다.
글로벌 의약품 시장조사기관 이밸류에이트파마(EvaluatePharma)는 최신 보고서를 통해 지난해 FDA가 54개 신약에 허가를 내주면서 의약품시장 규모가 238억달러 증가할 것이란 전망을 내놨다.
FDA 허가현황에는 의약품시장 개발 트렌드도 반영된다. 지난해 CDER이 허가한 신약 명단을 살펴보면 희귀질환 치료제가 22건으로 44% 비중을 차지했다. 희귀질환 전문기업 버텍스파마슈티컬즈가 지난해 10월 허가받은 낭포성섬유증 치료신약 '트리카프타(Trikafta)'가 대표적이다. 버텍스는 F508del 유전자 변이를 한가지 이상 동반한 12세 이상 낭포성섬유증 환자 대상의 3상임상에서 폐기능개선 효과를 입증하면서 예정보다 5개월 빨리 FDA 허가를 받았다.
x
AD
버텍스는 과거 치료제가 전무했던 낭포성섬유증 영역에서 독보적인 영향력을 구축하고 있다. 트리카프타는 버텍스가 4번째로 선보이는 낭포성섬유증 치료제다. 버텍스는 트리카프타의 연간 치료비용을 31만1000만달러(약 3조6000억원)로 책정하면서 발매와 동시에 블록버스터 등극을 예고했다.
통상적으로 10개월가량 소요된다고 알려졌던 FDA 심사기간은 점차 단축되는 추세다. 이 같은 현상은 아스트라제네카와 다이이찌산쿄가 공동 개발한 항체약물복합체(ADC) '엔허투(Enhertu)' 허가사례에 잘 반영된다.
엔허투는 수술이 불가능하고 앞서 2가지 이상의 약물치료를 받았던 HER2(상피세포성장인자수용체2) 양성 전이성 유방암 환자에게 3차치료제로 처방되는 항암제다. HER2 항체에 테트라펩타이드 링커를 이용해 국소이성화효소1(Topoisomerase1) 억제제를 결합시킴으로써 DNA 복제과정에서 발생하는 손상을 복구하도록 설계됐다.
전문의약품 허가신청자 비용부담법(PDUFA)에 따라 올해 2분기 중 허가 여부가 결정될 것으로 알려졌지만 FDA 획기적치료제와 우선심사 지정절차를 밟으면서 서류접수 2개월만에 판매허가를 받았다. 당초 예상보다 상업화 시기가 3개월가량 앞당겨진 셈이다.
다이이찌산쿄와 아스트라제네카는 지난 7일(현지시각)부터 미국에서 엔허투 공급을 시작했다. 시장 공급가(ASP)는 100g 용량 한바이알당 2295달러95센트다. 글로벌 의약품 시장조사기관 이밸류에이트파마(EvaluatePharma)는 2020년 전망 보고서에서 엔허투의 미국 매출액이 5년 뒤 24억1200만달러(약 2조8000억원)에 이를 것으로 추산했다.
엔허투 외에도 얀센의 표적항암제 '발버사(Balversa)'와 중국 베이진이 개발한 외투세포림프종 치료제 '브루킨사(Brukinsa)', 로슈의 미만성거대B세포림프종(DLBCL) 치료제 '폴리비(Polivy)' 등 29개 신약이 FDA 심사기간을 단축시켰다. 지난해 CDER 허가신약 48건 중 신속심사(Fast Track), 획기적치료제지정(BTD), 우선심사(priority review), 신속허가(accelerated approval) 등을 활용한 사례는 60%로 집계된다.
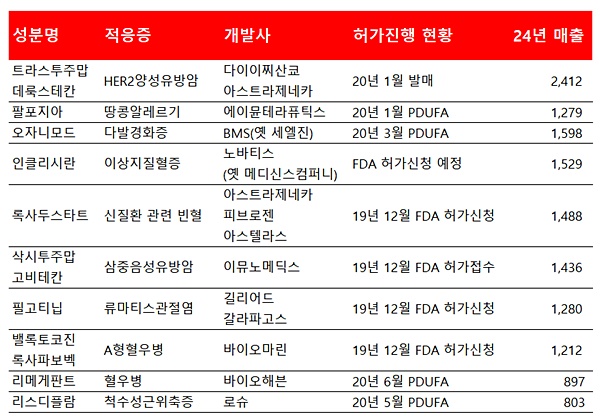
올해도 다양한 기전의 유망신약들이 FDA 심사 결과를 기다리고 있다. 이밸류에이트파마는 최신 보고서에서 단기간 내 FDA 허가가 예상되는 신약파이프라인 중 시장성이 높은 후보군 10종을 지목했다. 판매를 시작한 엔허투를 제외할 때 가장 매출규모가 큰 의약품은 BMS의 재발완화형 다발경화증 치료제 '오자니모드(Ozanimod)'다. 오자니모드는 3월에 FDA 최종 허가를 받을 경우 2024년 매출이 15억9800만달러까지 증가할 것으로 전망됐다.
FDA 허가신청이 임박한 노바티스의 이상지혈증 치료제 '인클리시란(Inclisiran)'은 15억2900만달러, 아스트라제네카와 피브로젠, 아스텔라스가 공동개발한 빈혈 치료제 '록사두스태트(Roxadustat)'는 14억8800만달러의 매출잠재력을 가진 것으로 나타났다.

▲ 지난해 FDA 허가를 받은 트리카프타(왼쪽)와 엔허투 제품사진
통상적으로 10개월가량 소요된다고 알려졌던 FDA 심사기간은 점차 단축되는 추세다. 이 같은 현상은 아스트라제네카와 다이이찌산쿄가 공동 개발한 항체약물복합체(ADC) '엔허투(Enhertu)' 허가사례에 잘 반영된다.
엔허투는 수술이 불가능하고 앞서 2가지 이상의 약물치료를 받았던 HER2(상피세포성장인자수용체2) 양성 전이성 유방암 환자에게 3차치료제로 처방되는 항암제다. HER2 항체에 테트라펩타이드 링커를 이용해 국소이성화효소1(Topoisomerase1) 억제제를 결합시킴으로써 DNA 복제과정에서 발생하는 손상을 복구하도록 설계됐다.
전문의약품 허가신청자 비용부담법(PDUFA)에 따라 올해 2분기 중 허가 여부가 결정될 것으로 알려졌지만 FDA 획기적치료제와 우선심사 지정절차를 밟으면서 서류접수 2개월만에 판매허가를 받았다. 당초 예상보다 상업화 시기가 3개월가량 앞당겨진 셈이다.
다이이찌산쿄와 아스트라제네카는 지난 7일(현지시각)부터 미국에서 엔허투 공급을 시작했다. 시장 공급가(ASP)는 100g 용량 한바이알당 2295달러95센트다. 글로벌 의약품 시장조사기관 이밸류에이트파마(EvaluatePharma)는 2020년 전망 보고서에서 엔허투의 미국 매출액이 5년 뒤 24억1200만달러(약 2조8000억원)에 이를 것으로 추산했다.
엔허투 외에도 얀센의 표적항암제 '발버사(Balversa)'와 중국 베이진이 개발한 외투세포림프종 치료제 '브루킨사(Brukinsa)', 로슈의 미만성거대B세포림프종(DLBCL) 치료제 '폴리비(Polivy)' 등 29개 신약이 FDA 심사기간을 단축시켰다. 지난해 CDER 허가신약 48건 중 신속심사(Fast Track), 획기적치료제지정(BTD), 우선심사(priority review), 신속허가(accelerated approval) 등을 활용한 사례는 60%로 집계된다.
▲ FDA 허가 또는 발매가 임박한 신약파이프라인의 2024년 예상매출 규모(단위: 백만달러, 자료: 이밸류에이트파마, 데일리팜 재구성)
올해도 다양한 기전의 유망신약들이 FDA 심사 결과를 기다리고 있다. 이밸류에이트파마는 최신 보고서에서 단기간 내 FDA 허가가 예상되는 신약파이프라인 중 시장성이 높은 후보군 10종을 지목했다. 판매를 시작한 엔허투를 제외할 때 가장 매출규모가 큰 의약품은 BMS의 재발완화형 다발경화증 치료제 '오자니모드(Ozanimod)'다. 오자니모드는 3월에 FDA 최종 허가를 받을 경우 2024년 매출이 15억9800만달러까지 증가할 것으로 전망됐다.
FDA 허가신청이 임박한 노바티스의 이상지혈증 치료제 '인클리시란(Inclisiran)'은 15억2900만달러, 아스트라제네카와 피브로젠, 아스텔라스가 공동개발한 빈혈 치료제 '록사두스태트(Roxadustat)'는 14억8800만달러의 매출잠재력을 가진 것으로 나타났다.
게시글 찬성/반대
- 3추천
- 0반대
내 아이디와 비밀번호가 유출되었다? 자세히보기 →
운영배심원의견
운영배심원의견이란
운영배심원 의견이란?
게시판 활동 내용에 따라 매월 새롭게 선정되는
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.







댓글목록