뉴스핌 | 2020-10-17 10:02:11
[서울=뉴스핌] 이영기 기자 =미국식품의약국(FDA)가 미국제약사 길리어드가 개발한 렘데시비를 코로나19(COVID-19)치료에 긴급사용승인(EUA)를 재발급했다.
FDA의 긴급사용승인 이후 세계보건기구(WHO)가 시험한 결과 효과가 없다는 입장을 내놔 논란이 일어나자 이에 대응해 재발급한 것이다.
16일(현지시간) 로이터통신은 FDA가 길리어드에 보내는 편지에서 이날자로 긴급사용승인을 재발급한다고 밝혔다고 보도했다.
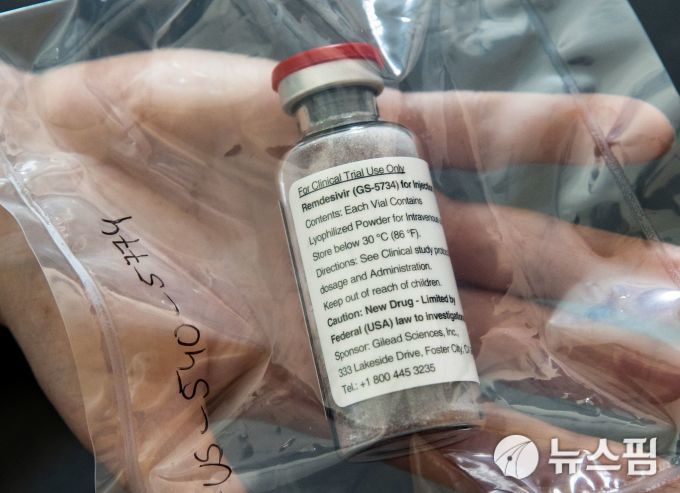 |
| 렘데시비르 [사진=로이터 뉴스핌] |
지난 1일자에 이미 EUA가 발급됐지만 이후 입원환자에 대해 사용가능하다는 점을 재확인 한 것이다.
앞서 전날 코로나19 치료제로 사용돼 온 렘데시비르가 환자의 치명률을 낮추는 데 유의미한 효과가 없다는 보고서에서 WHO는 렘데시비르 개발사인 미국 제약사 길리어드가 신뢰성 문제를 제기했다.
WHO는 렘데시비르 외에도 하이드록시클로로퀸, 에이즈 치료제인 로피나비르, 인터페론(interferon) 등 4가지 약물의 코로나 치료제로서의 효과를 측정하는 연대 임상 시험(Solidarity Trial) 결과 4가지 약물 모두 환자의 치명률을 낮추거나 회복기간을 단축시키는 데 큰 효과가 없다고 발표했다.
WHO는 전 세계 30여개국에서 1만1266명의 성인 환자를 대상으로 임상 시험을 실시했다. 연대 임상 시험은 전 세계에서 코로나19 치료제를 찾기 위한 목적으로 진행되고 있다.
이에 대해 곧바로 길리어드는 1062명의 환자를 위약군과 대조 실험하는 등 다른 임상 시험에서는 회복기간 단축 효과가 명백히 증명됐다며 WHO의 발표에 반박했다.
그러면서 "WHO의 임상 시험은 지역과 환자마다 다른 환경에서 이뤄져 결정적 결론을 내리기 어렵고, 다른 과학자들로부터 검증을 받지도 못했으며, 결론이 성급히 내려졌다"고 지적했다.
반면 "무작위 피험자를 대상으로 통제된 환경에서 실시한 다른 시험은 동료 심사 등을 통해 충분히 검증됐다"고 주장했다.
이에 대해 WHO 측은 외부 통계학자를 내세워 렘데시비르에 대한 WHO의 데이터는 신뢰할 수 있다고 반박했다.
이같이 반박과 재반박이 이어지며 논란이 일어나자, FDA는 EUA를 재발급함으로서 길리어드에 힘을 실은 셈이다.
 |
| 미국 식품의약국(FDA) [사진= 로이터 뉴스핌] |
007@newspim.com
렘데시비르 효과 있다 vs 없다...길리어드-WHO 논쟁"렘데시비르, 코로나19 치명률 개선에 큰 효과 없어" - WHO
트럼프, 항체칵테일·렘데시비르·덱사메타손 등 3가지 치료 받았다
미국 병원들, 렘데시비르 할당분 1/3 매입 거절..."계속 제한적 사용"
FDA, 모든 코로나 환자에게 렘데시비르 응급 사용 확대 승인
EU집행위, 코로나 치료제 렘데시비르 3만명분 구매 계약
저작권자(c) 글로벌리더의 지름길 종합뉴스통신사 뉴스핌(Newspim), 무단 전재-재배포 금지
- 한줄 의견이 없습니다.